联系人:苏先生
手 机:18612706349
电 话:010-57297418
传 真:010-57297418
邮 箱:suylinchcn@163.com
地 址:北京市北京经济技术开
发区荣华中路8号院13
号楼10层1111
邮 编:100176
线粒体状态呼吸液相氧电极测定方法

文章链接:https://doi.org/10.1016/j.xpro.2021.100735
线粒体是细胞物质代谢和能量代谢的枢纽,也是逆境胁迫的主要攻击位点之一,在生物和非生物逆境胁迫条件下,细胞线粒体正常功能的维持对生物抵抗逆境能力的大小起至关重要的作用。在线粒体呼吸过程中,呼吸电子传递伴随着跨线粒体膜质子梯度的形成,ATP合酶利用这一跨膜质子梯度合成ATP,在正常细胞中,线粒体的电子与质子传递是与氧化磷酸化相偶联的,因此ADP的供应会影响到呼吸电子传递的速率。在通常情况下,呼吸电子传递的底物如琥珀酸、NADH是充足的,ADP的供应往往作为限制因素,从而调节整个呼吸过程。

为了精确地研究这种基于ADP的呼吸控制,Chance和Williams(1956)根据呼吸底物以及ADP不同存在情况下的线粒体呼吸速率,提出呼吸状态(又称状态呼吸,respiration state)的概念:
状态I呼吸是指在没有添加任何呼吸底物及ADP情况下线粒体的呼吸速率(内源呼吸);
加入ADP之后的呼吸速率称为状态II呼吸;
在呼吸底物和ADP都存在时的呼吸速率称为状态III呼吸(最大呼吸);
ADP被消耗殆尽但呼吸底物仍然剩余时的呼吸速率称为状态IV呼吸(剩余呼吸)。

由于在完整的生物细胞内,线粒体呼吸受到细胞内其它物质代谢以及能量代谢的影响,直接测定细胞的呼吸不能精确地反映线粒体的功能,因此建立一种能够相对精确测定线粒体内各种状态呼吸的方法至关重要。
本文列出了改进后的液相氧电极测定小鼠肌肉细胞线粒体的状态呼吸过程的方法。主要内容有氧气消耗速率(OCR)、磷氧比(P/O)、呼吸控制率(RCR)和寡霉素敏感呼吸等测定方法。
测定步骤:
1. 配制所需试剂溶液(点击“阅读原文”查看详细信息)
2. 安装并校准液相氧电极
3. 提取线粒体(点击“阅读原文”查看详细信息)
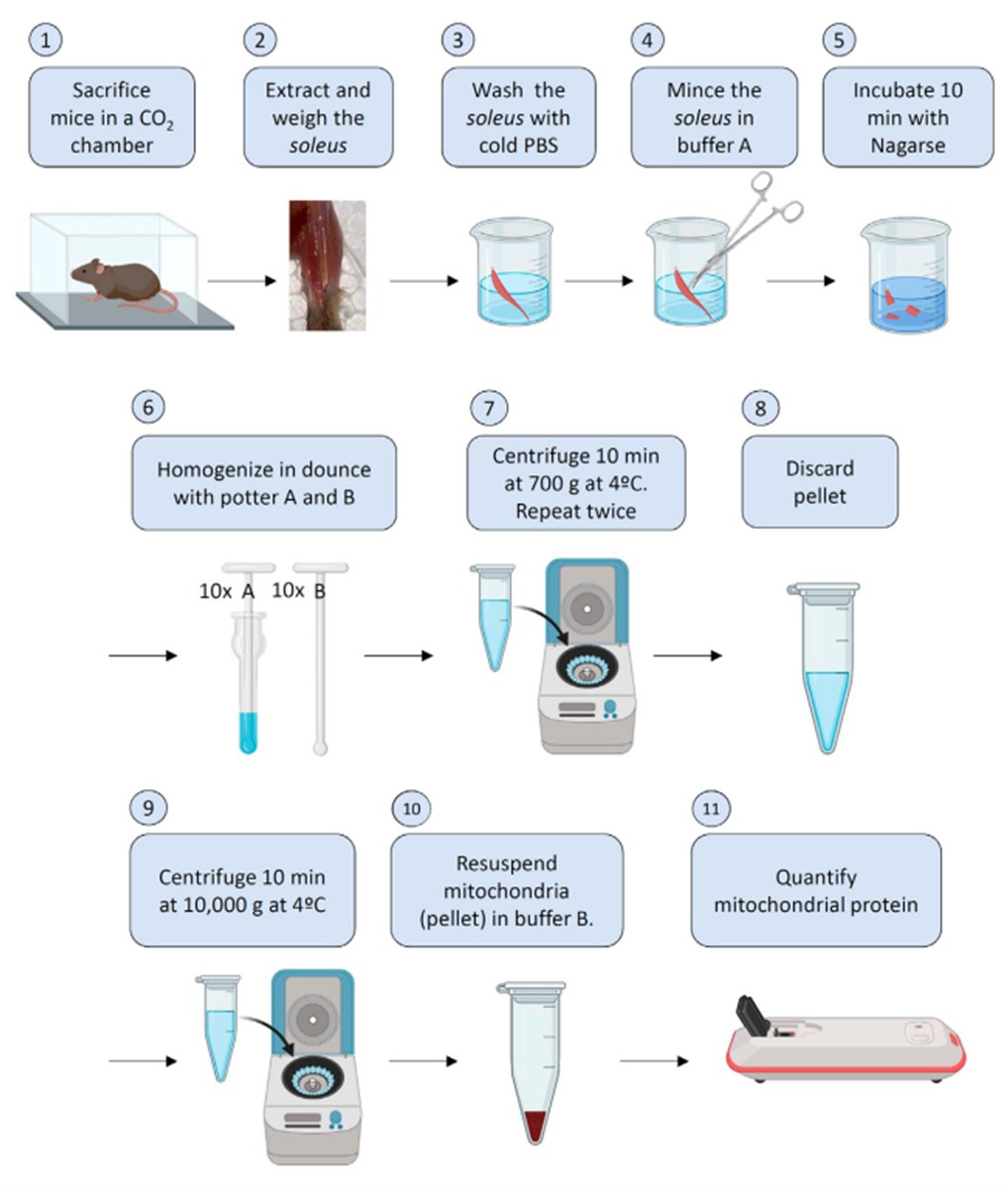
图1. 线粒体提取流程
4. 测定过程:线粒体氧气消耗速率(OCR)及状态呼吸
4.1 向反应室中加入适量的呼吸缓冲液。
4.2 向反应室中加入适量的线粒体。
4.3 盖上反应杯盖。
4.4 点击“Go”开始测定(此阶段为状态I)。
4.5 在约30s时加入呼吸底物(此阶段为状态IV)。
4.6 在约2min 30s时,使用注射器向反应室中加入ADP(此阶段为状态III)。

图2. 液相氧电极测定线粒体状态呼吸流程
4.7 等待所有的ADP消耗,转换为ATP,此时反应室只有底物,反应速率降低,斜率变缓(此阶段为状态IV)。
4.8 在约4min 30s时加入ADP。
4.9 在约5min 30s时加入寡霉素。
4.10 在约6min 30s时,加入FCCP(可获得最大呼吸)。
4.11 在约7min 30s时,加入抗霉素A(终止呼吸)。
4.12 在约8min 30s时,停止测定并保存数据。
5. 预期结果
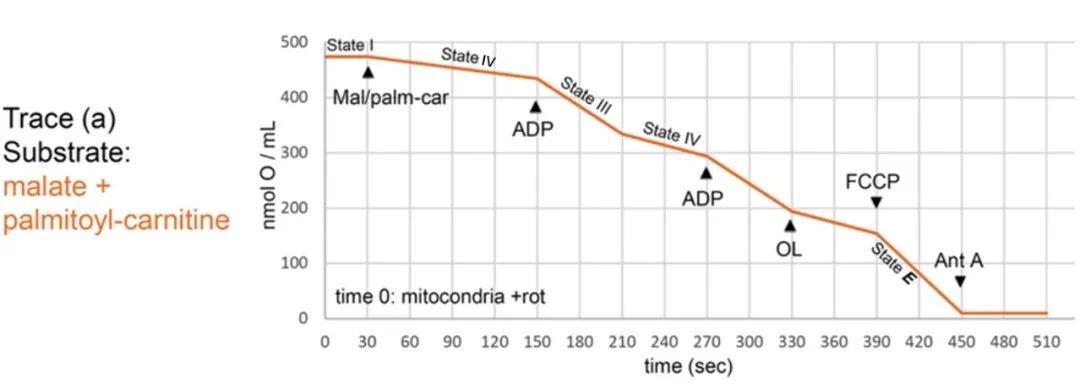 图3. 健康组织线粒体不同底物状态呼吸预期曲线
图3. 健康组织线粒体不同底物状态呼吸预期曲线
6. 数据获取和计算
6.1 氧气消耗速率(OxygenConsumption Rate,OCR):根据一定时间内线粒体消耗氧气量计算获得的。氧电极软件(OxyTrace+或者O2view)有斜率截取功能。
6.2 呼吸控制率(Respiration Control Index/Rate,RCI or RCR):计算方式为状态III/状态IV(L),该值是耦合线粒体的控制指标。
6.3 磷氧比(P/O,Phosphate/OxygenRatio):根据状态III反应前后反应室中的氧气含量,可以计算出整个状态III阶段的耗氧总量(此时算出的是O2分子数目),最后将测定状态III时加入ADP的量(分子数目)除以耗氧总量(换算成O原子数目)即得到被测线粒体的P/O。
6.4 寡霉素敏感呼吸(OSR):将状态III斜率与注射寡霉素后获得的斜率进行计算。该值代表H+-ATP合酶活性(注:H+-ATP合酶功能失调可能导致Δψm的改变)。
7. 注意事项
7.1 盖上反应杯盖后所有试剂均应使用注射器进行添加。
7.2 需要留出足够的时间计算加入试剂之后的斜率。上文所示添加试剂的时间并不是固定的,具体时间仍需根据实际情况进行相应调整,建议提前准备预实验。
7.3 建议同一处理至少进行3次重复以保证其代表性。
7.4 低于初始氧浓度10%时可能出现呼吸限制,影响正常测定。确保在氧气限制之前完成实验。
进度条,百分之0
00:00
/
03:11
03:11
全屏
倍速播放中
您的浏览器不支持 video 标签
继续观看
线粒体状态呼吸液相氧电极测定方法
7.5 每次注射后,至少用乙醇和水仔细清洁注射器两次。
7.6 上文中添加试剂的体积和浓度需根据具体待测对象确定,可参考文末相关文献
7.7 温度对氧电极影响较大,实验必须在恒温下进行。
7.8 底物和抑制剂易在反复冻融中降解,强烈建议使用新鲜制备的试剂。
8. 问题及解决方法
8.1 如何确保氧电极正常工作?
开始测定,单击GO。等待信号线稳定。如果信号线稳定,则氧电极工作正常,如果信号线波动较大,氧电极工作不正常。此时需拆卸电极,重新清洁电极,重新安装校正。
8.2 如何检查线粒体是否解耦联?
通过向线粒体体系中添加外源细胞色素c(cyt c)进行呼吸测定。如果线粒体在制备过程中受损或解偶联,添加cyt c将增加氧通量,表示外膜的损伤和内源cyt c的丢失。
8.3 线粒体未偶联(低RCR)
可能是缓冲液配制错误或储存不当。建议重新配制所有缓冲液。肥胖和衰老的动物细胞,线粒体质子泄漏增加,线粒体内膜脂质成分改变,RCR会偏低。确保对照组动物年轻健康。
8.4 多次测定后线粒体对底物/抑制剂的反应不正常
可能是氧电极反应室中存在微量抑制剂或杂质(清洁不彻底)。此时需用超纯水、乙醇和超纯水彻底清洁反应室。也可向反应室内添加PBS+1%BSA,以增强清洁效果。增加洗涤时间也有助于去除抑制剂。
8.5 电极不灵敏(斜率缓慢,信号线不稳定)
检查反应室中是否存在气泡。如果有气泡,可使用吸管反复轻微吸打溶液。检查铂极附近是否有气泡,如果有,需拆卸重新安装电极。或者适当增加反应室中线粒体蛋白的浓度。
9. 相关阅读
9.3 积雪草酸通过线粒体定向防护机制改善大鼠肝脏缺血再灌注损伤
10. 相关文献
[1] 刘美君, 孙学娟, 张子山,等. 植物线粒体呼吸状态的研究方法及其在植物生物学中的应用[J]. 植物生理学报, 2014,50(1):6.
[2] Balaban, R.S., Nemoto, S., and Finkel,T. (2005).Mitochondria, oxidants, and aging. Cell 120,483–495.
[3] Benador, I.Y., Veliova, M., Liesa, M.,and Shirihai,O.S. (2019). Mitochondria bound to lipid droplets:wheremitochondrial dynamics regulate lipid storage and utilization. Cell Metab 29,827–835.
[4] Benador, I.Y., Veliova, M., Liesa, M.,and Shirihai,O.S. (2019). Mitochondria bound to lipid droplets:wheremitochondrial dynamics regulate lipid storage and utilization. Cell Metab 29,827–835.
[5] Cadenas, S. (2018). Mitochondrial uncoupling,ROS generation and cardioprotection. Biochim Biophys Acta Bioenerg 1859,940–950.
[6] Chance B, Williams GR (1956). Therespiratory chain and oxidative phosphorylation. In: Meister A (ed). Advancesin Enzymology and Related Areas of Molecular Biology. New York: IntersciencePublishers, INC, 65~134
[7] Chen, Y. C., Taylor, E. B., Dephoure,N., Heo, J. M., Tonhato, A., Papandreou, I., ... & Rutter, J. (2012).Identification of a protein mediating respiratory supercomplexstability. Cell metabolism, 15(3), 348-360.
[8] Dillin, A., Hsu, A.L., Arantes-Oliveira,N., Lehrer-Graiwer, J., Hsin, H., Fraser, A.G., Kamath, R.S.,Ahringer, J., andKenyon, C. (2002). Rates of behavior and aging specified by mitochondrialfunction during development. Science 298, 2398–2401.
[9] Esparza-Molto´, P.B., and Cuezva, J.M.(2018). The role of mitochondrial H+-ATP synthase in cancer.Front Oncol 8, 53.
[10] Formentini, L., Ryan, A.J.,Galvez-Santisteban, M.,Carter, L., Taub, P., Lapek, J.D., Jr., Gonzalez,D.J.,Villarreal, F., Ciaraldi, T.P., Cuezva, J.M., et al.(2017a). MitochondrialH+-ATP synthase in human skeletal muscle: contribution to dyslipidaemia andinsulin resistance. Diabetologia 60, 2052–2065.
[11] Gnaiger, E.(2020).Mitochondrial pathwaysand respiratory control. an introductionto OXPHOS analysis. Bioenergetics Communications 2020.5th edition.
[12] Hernansanz-Agustín, P., Choya-Foces, C.,Carregal-Romero, S., Ramos, E., Oliva, T., Villa-Piña, T., ... &Martínez-Ruiz, A. (2020). Na+ controls hypoxic signalling by the mitochondrialrespiratory chain. Nature, 586(7828), 287-291.
[13] Kauppila, T.E.S., Kauppila, J.H.K., andLarsson,N.G. (2017). Mammalian mitochondria and aging:an update. Cell Metab 25,57–71.
[14] Lapuente-Brun, E., Moreno-Loshuertos,R., Acín-Pérez, R., Latorre-Pellicer, A., Colás, C., Balsa, E., ... &Enríquez, J. A. (2013). Supercomplex assembly determines electron flux in themitochondrial electron transport chain. Science, 340(6140),1567-1570.
[15] Nicholls, D.G. (2013). Bioenergetics-4th Edition(Academic Press),Paperback ISBN:9780123884251. eBook ISBN: 9780123884312.
[16] Nuevo-Tapioles, C., Santacatterina, F.,Stamatakis,K., Nunez de Arenas, C., Gomez de Cedron, M.,Formentini, L., andCuezva, J.M. (2020). Coordinate beta-adrenergic inhibition of mitochondrialactivity and angiogenesis arrest tumor growth. Nat Commun 11, 3606.
[17] Pesta, D., and Gnaiger, E. (2012).High-resolution respirometry: OXPHOS protocols for human cells andpermeabilized fibers from small biopsies of human muscle. Methods Mol Biol 810,25–58.
[18] Rial, E., Poustie, A., and Nicholls,D.G. (1983).Brown-adipose-tissue mitochondria: the regulation of the 32000-Mruncoupling protein by fatty acids and purine nucleotides. Eur J Biochem137,197–203.
[19] Sanchez-Gonzalez, C., Nuevo-Tapioles,C., Herrero Martin, J.C., Pereira, M.P., Serrano Sanz, S.,Ramirez de Molina,A., Cuezva, J.M., and Formentini, L. (2020). Dysfunctional oxidativephosphorylation shunts branched-chain amino acid catabolism onto lipogenesis inskeletal muscle. EMBO J 39, e103812.
[20] Santacatterina, F., Sanchez-Cenizo, L.,Formentini,L., Mobasher, M.A., Casas, E., Rueda, C.B.,Martinez-Reyes, I., Nunezde Arenas, C., Garcia-Bermudez, J., Zapata, J.M., et al. (2016).Down-regulation of oxidative phosphorylation in the liver by expression of theATPase inhibitory factor 1 induces a tumor-promoter metabolic state. Oncotarget7, 490–508.
[21] Scialo, F., Sriram, A., Fernandez-Ayala,D., Gubina, N., Lohmus, M., Nelson, G., Logan, A., Cooper, H.M., Navas, P.,Enriquez, J.A., et al. (2016).Mitochondrial ROS produced via reverse electrontransportextend animal lifespan. Cell Metab 23,725–734.
[22] Sokolovski, S. G., Rafailov, E. U.,Abramov, A. Y., & Angelova, P. R. (2021). Singlet oxygen stimulatesmitochondrial bioenergetics in brain cells. Free Radical Biology andMedicine, 163, 306-313.
暂无信息
